Larutan Elektrolit dan Non Elektrolit – Pembahasan kali ini akan menjelaskan mengenai sebuah materi mengenai Larutan Elektrolit dan Non Elektrolit yang mana meliputi pengertian, ciri , jenis dan juga contohnya . Sebelumnya apakah kamu tahu apa itu yang dimaksud dengan larutan elektrolit ? jika belum maka langsung saja kita simak penjelasan selengkapnya berikut ini.
Contents
Pengertian Larutan Elektrolit
Larutan elektrolit adalah larutan yang bisa menghantarkan arus listrik. Didalam larutan elektrolit tersebut molekulnya terurai dan terdisosiasi, menjadi beberapa partikel yang muatannya positif dan muatan negatif. Yang disebut dengan ion baik positif maupun ion negatif.
Ion positif yang dihasilkan tersebut dinamakan dengan kation, dan ion negatif yang dihasilkan disebut dengan anion. Jumlah dari muatan ion positif dan ion negatif akan sama, sehingga muatan ion berada dalam larutan yang netral. Ion tersebutlah yang kemudian dapat menghantarkan listrik.
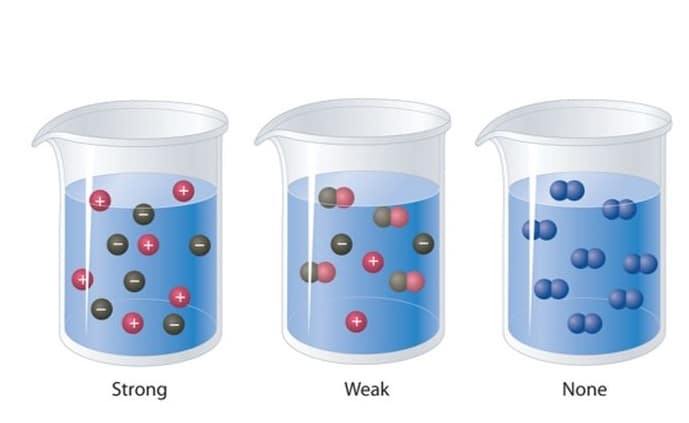
Perubahan kimia larutan ditandai dengan adanya perubahan warna, dengan munculnya gelembung gas serta juga adanya endapan. Dan apabila di uji dengan menggunakan alat uji elektrolit larutan tersebut mampu menyalakan lampu. Semakin banyaknya ion yang terbentuk, maka akan semakin kuatlah sifat elektrolit larutan tersebut .
Jenis Larutan Elektrolit
Larutan elektrolit dibagi menjadi tiga yang terdiri dari ciri – ciri yaitu sebagai berikut ini :
Larutan Elektrolit Kuat
Larutan elektrolit kuat yaitu adalah larutan yang semua molekulnya terurai, menjadi beberapa ion yang terionisasi dengan sempurna. Karena dengan banyaknya ion penghantar listrik yang terbentuk, maka daya hantarnyapun akan semakin kuat. Pada umumnya larutan elektrolit yang kuat adalah larutan garam.
Ciri dari larutan elektrolit kuat adalah :
- Penghantar arus listriknya kuat dan baik .
- Terionisasi dengan sempurna .
- Tetapan ataupun derajat ionisasi ( a ) a = 1.
- Bila diuji larutan elektrolit kuatnya memiliki nyala lampu yang terang, dan muncullah gelembung gas yang jumlahnya banyak.
Contohnya :
- Garam ( NaCl, KCl, CuSO4 dan KNO3 ),
- Asam Kuat ( HCl, HI, HBr, H2SO4 dan HNO3 ), dan
- Basa Kuat ( NaOH, Ca ( OH )2, Mg ( OH ) 2 dan KOH )
Reaksi dari penguraian yang kuat ditulis dengan tanda anak panah tunggal ke kanan. Contohnya yaitu :
- NaCl ( aq ) → Na + ( aq ) + Cl – ( aq )
- H2SO4 ( aq ) → 2 H + ( aq ) + SO4 2 – ( aq )
- NaOH ( aq ) → Na+ ( aq ) + OH– ( aq )
Larutan Elektrolit Lemah
Larutan Elektrolit Lemah adalah jenis larutan yang dimana larutannya tidak semuanya terionisasi dengan sempurna, sehingga hanya terdapat sedikit ion yang dapat menghantarkan listrik.
Ciri – Ciri larutan elektrolit yang lemah yaitu sebagai berikut :
- Penghantar listrik yang kurang baik atau lemah.
- Terionisasi sebagian.
- Tetapan atau derajat ionisasi ( a ) 0 < a < 1
- Bila diuji, larutan elektrolit lemah nyala lampunya lemah serta muncul gelembung gas yang sedikit.
Contoh Larutan Elektrolit Lemah
- Asam Lemah ( HCN, H3PO4, CH3COOH, dan C2O3 )
- Basa Lemah ( NH4OH, Al ( OH3 ),
- dan Fe ( OH ) 3 ).
Larutan Non Elektrolit
Larutan Non Elektrolit adalah jenis larutan yang tidak dapat menghantarkan arus listrik. Larutan non elektrolit terdiri dari beberapa zat yang terlarut didalam air, namun tidak terurai menjadi ion atau tidak terionisasi. Didalam larutannya, zat non elektrolit ini masih seperti molekul yang tidak mempunyai muatan listrik. Itulah sebabnya larutan ini tidak bisa menghantarkan arus listrik.
Ciri – Ciri Larutan Non Elektrolit
- Tidak bisa terionisasi.
- Tidak bisa menghantarkan arus listrik atau isolator.
- Tetapan atau derajat ionisasi (a ) a = 0
- Bila diuji, Larutan Non Elektrolit, tidak menyala dan tidak muncul gelembung gas.
Contoh Larutan Non Elektrolit
- Urea = CO ( NH2 )2
- Glukosa = C6H12O6
- Sukrosa = C12H22O11
- Etanol = C2H2OH
Contoh reaksi larutan non – elektrolit C6H12O6 ( s ) C6H12O6 ( aq )
Demikianlah penjelasan mengenai Larutan Elektrolit Dan Non Elektrolit semoga apa yang dijelaskan dapat bermanfaat dan juga berguna dalam menambah wawasan pengetahuan anda semua , sekian dan terimakasih.